下列属于化学变化的是
A .葡萄酿酒 B .金属导电 C .汽油挥发 D .空气液化
下列物质由分子构成的是
A .锌 B .氮气 C .石墨 D .氯化钾
水是生命之源。下列有关水的叙述正确的是( )
A .长江水属于纯净物 B .长期饮用硬水有利人体健康
C .工业废水需处理达标后排放 D .过滤可以除去水中所有杂质
下列有关 “ 铜绿 ” 性质研究的实验操作中,正确的是
A . 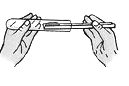 取用 “ 铜绿 ” B .
取用 “ 铜绿 ” B . 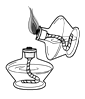 点燃酒精灯
点燃酒精灯
C .  加热 “ 铜绿 ” D .
加热 “ 铜绿 ” D . 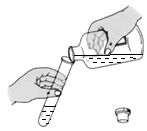 加入盐酸
加入盐酸
硫酸是重要的化工原料。下列有关硫酸的说法错误的是
A .浓硫酸具有吸水性 B .稀硫酸能与纯碱反应
C .浓硫酸稀释后温度降低 D .稀硫酸可用于金属表面除锈
下列有关溶液的说法正确的是
A .碘酒溶液中,酒精为溶质 B .向水中加入蔗糖,导电性明显增强
C .氢氧化钙的溶解度随温度升高而增大 D .积雪的路而撒食盐、可以促进积雪融化
推理和归纳是化学学习常用的思维方法。下列推理确的是
A .燃烧都有发光发热现象,则有发光发热现象的变化一定是燃烧
B .置换反应都有单质生成,则有单质生成的反应一定是置换反应
C .中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应
D .单质是由一种元素组成的纯净物,则一种元素组成的纯净物一定是单质
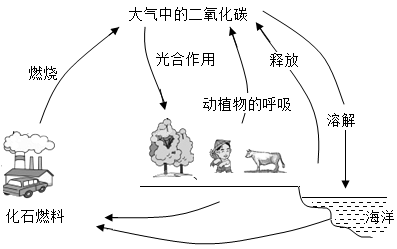
抗击新冠肺炎疫情需用多种消毒剂。氯气用于生产含氯消毒剂,氯气与水反应的微观示意图如下。下列说法正确的是
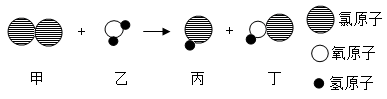
A .该反应前后元素化合价均没有变化 B .反应物和生成物中共有两种氧化物
C .参加反应的甲、乙质量比为 71 : 18 D .丙物质的水溶液能使红色石蕊试纸变蓝
高纯碳酸钙广泛应用于精密电子陶瓷、医药等生产。下图为模拟制备高纯碳酸钙的主要流程,已知该大理石中杂质是二氧化硅和氧化铁。下列有关说法错误的是
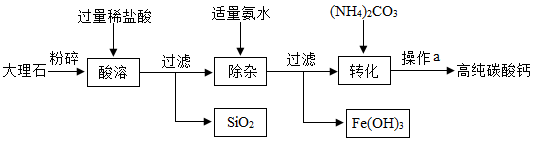
A .由 “ 酸溶 ” 可知,二氧化硅不溶于水和稀盐酸
B . “ 除杂 ” 中,氨水只与溶液中的氯化铁反应
C . “ 转化 ” 发生的主要反应是
D .操作 a 为组合操作,包含过滤、洗涤、干燥
江苏省第 20 届运动会将于 2022 年 8 月 28 日在泰州盛大开幕。届时,泰州将以先进的体育场馆、优美的城市环境和可口的特色美食迎接全省运动员和四方宾朋。
10 .体育公园建设使用的材料中,属于有机合成材料的是
A .玻璃 B .硬铝 C .钢筋混凝土 D .塑料管道
11 .下列泰州特产中富含蛋白质的是
A .靖江肉脯 B .泰兴雪梨 C .姜堰大米 D .兴化菜籽油
12 .场馆的绿植养护需要多种化学肥料。下列属于复合肥料的是
A . (NH 4 ) 2 SO 4 B . K 2 SO 4 C . Ca(H 2 PO 4 ) 2 D . KNO 3
13 .体育馆屋面铺装了锰镁合金板,镁元素在元素周期表中的相关信息如图。下列说法正确的是
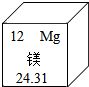
A .镁是一种非金属元素 B .镁元素的原子序数为 12
C .镁元素的相对原子质量为 24.31g D .镁离子有 12 个电子
下列实验操作能够达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 鉴别羊毛线和棉线 | 取样,灼烧,闻气味 |
| B | 除去粗盐中的难溶性杂质 | 溶解,蒸发结晶 |
| C | 测定柠檬汁的 pH | 取样,滴在湿润的 pH 试纸上,对照 |
| D | 检验某化肥是否为铵态氮肥 | 取样,加入熟石灰,研磨,闻气味 |
A . A B . B C . C D . D
某兴趣小组利用氧气传感器探究不同物质在空气中燃烧的耗氧量情况。足量蜡烛和红磷分别在相同的密闭容器中燃烧,测定的氧气含量变化如图所示。下列判断正确的是
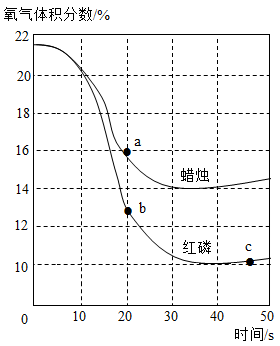
A .蜡烛燃烧过程中, a 点时容器内氮气体积分数为 84%
B .红磷燃烧过程中, b 点和 c 点时容器内物质总质量相等
C .燃烧后,两容器中氧气均未耗尽,红磷耗氧量较多
D .若将足量蜡烛和红磷放在同一密闭容器中燃烧,氧气的体积分数可降至 3%