下列制作传统工艺品过程中,原料发生化学变化的是
A .黏土烧制青花瓷 B .布料缝制香荷包
C .丝线编制中国结 D .玉石雕刻玉如意
若用小球表示原子,则分子模型 ![]() 可用于表示
可用于表示
A . Fe B . H 2 C . CO 2 D . NH 3
空气是一种宝贵的自然资源,其中可供人呼吸的是
A .氧气 B .氮气 C .二氧化碳 D .稀有气体
酒精灯是实验室常用的仪器。下列涉及酒精灯的操作正确的是
A . 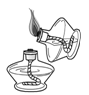 点燃酒精灯 B .
点燃酒精灯 B . 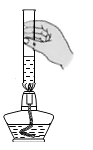 加热液体
加热液体
C .  点燃木炭 D .
点燃木炭 D .  熄灭酒精灯
熄灭酒精灯
从微观角度认识水蒸发变成水蒸气的过程,下列说法错误的是
A .水分子在不断运动 B .水分子间间隔变大
C .水分子质量不变 D .分子种类发生改变
东东同学用 pH 试纸测定家中几种物质的 pH ,数据如下表。其中呈碱性,不宜用手直接接触的是
| 物质 | 白醋 | 橘汁 | 纯净水 | 炉具清洁剂 |
| pH | 2 | 3 | 7 | 13 |
A .白醋 B .橘汁 C .纯净水 D .炉具清洁剂
关于 “ 粗盐中难溶性杂质的去除 ” 实验,下列说法错误的是
A .溶解:为加快粗盐的溶解,可预先将粗盐研细
B .过滤:过滤食盐水时,需用玻璃棒引流
C .蒸发:蒸发皿中的水蒸干后,停止加热
D .分析:粗盐未完全溶解就过滤,则得到的精盐偏少
氢气与氯气反应的微观示意图如下,下列说法正确的是
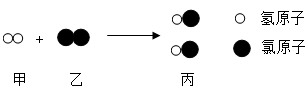
A .该反应属于化合反应 B .丙物质的化学式为 ClH
C .反应前后原子种类改变 D .参加反应的甲和乙的质量比为 1 : 1
中国人的饭碗要牢牢端在自己的手上。近期,中国科学家用化学方法成功将二氧化碳转化为淀粉。下列说法错误的是
A .淀粉属于糖类 B .淀粉分子中含有 CO 2
C .米饭、馒头中富含淀粉 D .该转化技术有利于解决粮食短缺问题
区分是利用物质性质的差异对物质进行区别的一种方法,下列实验设计不合理的是
| 选项 | 实验目的 | 实验设计 |
| A | 区分氯化钠溶液和碳酸钠溶液 | 分别取样于试管中,滴加酚酞溶液,观察溶液颜色 |
| B | 区分稀盐酸和稀硫酸 | 分别取样于试管中,将铜丝浸入,观察是否有气泡 |
| C | 区分氢氧化钠固体和硝酸铵固体 | 分别取样于烧杯中,加水溶解,测量温度的变化 |
| D | 区分固态化肥氯化铵和硝酸钾 | 分别取样于研钵中,加入熟石灰研磨,闻气味 |
A . A B . B C . C D . D
用化学用语回答下列问题:
(1) 氧元素的符号 ____________ 。
(2)2 个氧原子 ____________ 。
(3) 水的化学式 ____________ 。
我国近代化学先驱徐寿创造了 “ 钙 ” 等化学元素的汉语名称。根据下图回答下列问题:
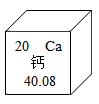
(1) 钙元素的原子序数为 ____________ 。
(2) 钙元素的相对原子质量为 ____________ 。
(3) 钙元素属于 ____________ (填 “ 金属 ”“ 非金属 ” 或 “ 稀有气体 ” )元素。
(4) 碳酸钙是一种重要的含钙化合物,请写出碳酸钙的一种用途 ____________ 。
下图是某牙膏成分表的一部分,回答下列问题:

(1) 牙膏属于 ____________ (填 “ 混合物 ” 或 “ 纯净物 ” )。
(2) 含氟牙膏能预防龋齿,这里的 “ 氟 ” 指的是 ____________ (填 “ 分子 ”“ 原子 ” 或 “ 元素 ” )。
(3) 二氧化硅( SiO 2 )中硅元素的化合价为 ____________ 。
(4) 人被有些蚊虫叮咬后,蚊虫在人的皮肤内分泌出蚁酸,使人产生痛痒感。在叮咬处涂抹牙膏就可减轻痛痒,说明该牙膏呈 ____________ (填 “ 酸性 ”“ 碱性 ” 或 “ 中性 ” )。
人类的日常生活、工农业生产和科学研究都离不开水。回答下列问题:
(1) 生活中区分硬水和软水,常用的物质是 ____________ 。
(2) 自来水厂常利用活性炭的 ____________ 性,除去水中的异味。
(3) 农业和园林浇灌时,改大水漫灌为喷灌、滴灌,主要目的是 ____________ 。
(4) 实验室用氢氧化钠固体和水配制溶液,其中作溶剂的是 ____________ 。
钢铁的生产和使用是人类文明和社会进步的一个重要标志。
(1) 赤铁矿(主要成分是 Fe 2 O 3 )可用于炼铁。 Fe 2 O 3 中铁、氧元素质量比为 _____ 。
(2) 钢是一种铁合金。钢和纯铁相比硬度较大的是 ____________ 。
(3) 将打磨后的铁丝放入硫酸铜溶液中,铁丝表面有红色物质生成,说明铁比铜的金属活动性 ____________ (填 “ 强 ” 或 “ 弱 ” )。
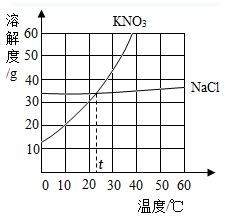
根据 NaC1 和 KNO 3 的溶解度表和溶解度曲线,回答下列问题:
| 温度 /℃ | 0 | 20 | 40 | |
| 溶解度 /g | NaCl | 35.7 | 36.0 | 36.6 |
| KNO 3 | 13.3 | 31.6 | 63.9 | |
(1)20℃ 时, KNO 3 的溶解度为 ____________g 。
(2)KNO 3 和 NaCl 两种物质的溶解度受温度影响较小的是 _____________ 。
(3) 按照下图进行实验,各步操作均已充分溶解,忽略实验过程中溶剂的挥发、下列说法正确的是
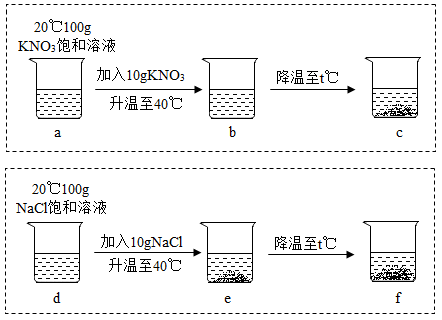
A .烧杯 a 和 b 内,溶液中溶质的质量分数: a<b
B .烧杯 a 和 d 内,溶剂质量: a>d
C .烧杯 c 和 f 内,上层清液中溶质的质量分数: c=f
D .烧杯 c 和 f 内,剩余固体质量: c>f
E .烧杯 b 内,溶液中溶质的质量分数约为 30.9%
可控的火是福,不可控的火是祸。下图是利用对比法探究燃烧条件的实验装置,回答下列问题:(已知:白磷的着火点为 40℃ ,红磷的着火点为 240℃ )
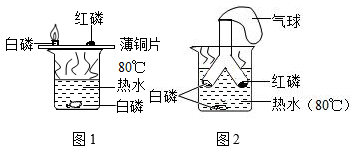
(1) 图 1 中薄铜片上的白磷燃烧而红磷不燃烧,说明燃烧需要的条件是 ____________ 。
(2) 图 1 中薄铜片上的白磷燃烧而水中白磷不燃烧,说明燃烧需要的条件是 ____________ 。
(3) 磷燃烧的生成物有毒。与图 1 装置相比,利用图 2 装置进行实验的优点是 ____________ 。
下图是实验室制取气体的常用装置,回答下列问题:
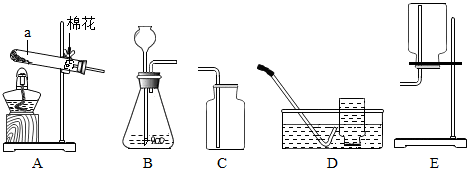
(1) 玻璃仪器 a 的名称是 _______________ 。
(2) 实验室用加热高锰酸钾固体的方法制取氧气。
① 写出该反应的化学方程式 ____________ 。
② 用该方法制取氧气的发生装置应选择 ____________ (填图示中的序号):
③ 氧气的收集装置可选择 ____________ (填图示中的序号)。
脱氧剂可以延长食品保质期。某脱氧剂的主要成分为铁粉、活性炭和氯化钠。针对该脱氧剂进行如下活动:
活动一:验证脱氧剂中含有铁粉和活性炭
【进行实验】
(1) 取脱氧剂样品于试管中,加入足量的稀盐酸,观察到有气泡产生,溶液变为浅绿色,说明脱氧剂中含有铁粉,写出该反应的化学方程式 ___________ 。
充分反应后,将试管中的固液混合物过滤、将滤渣洗涤、干燥,得到黑色固体。
(2) 如图所示,将黑色固体置于坩埚(耐高温容器)内,在电炉上灼烧,最终黑色固体全部消失。灼烧期间,在坩埚上方罩上烧杯,过一会儿,迅速把烧杯倒过来、向烧杯内注入澄清石灰水,振荡,观察到 ___________ 的现象,说明脱氧剂中含有活性炭。
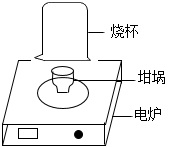
【反思与评价】
(3) 用酒精灯替换电炉重复( 2 )实验,虽出现相同现象,但会影响实验结论,其原因是 ___________ 。
活动二:探究脱氧剂中氯化钠的作用
【查阅资料】脱氧剂能延长食品保质期是利用了铁生锈的原理
【猜想与假设】氯化钠可能影响铁生锈的速率
【进行实验】按下图所示 A 、 B 装置进行实验,相同温度下,每隔一段时间测量导管中水面上升高度,实验数据如下表。
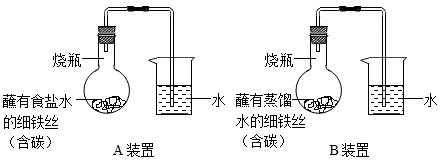
| 时间 /h | 0 | 1.0 | 2.0 | 3.0 |
| A 装置导管中水面上升高度 /cm | 0 | 1.2 | 5.6 | 9.7 |
| B 装置导管中水面上升高度 /cm | 0 | 0 | 0.8 | 3.5 |
【解释与结论】
(4) 从化学、物理两个视角综合分析, A 、 B 装置导管中水面上升的原因是 _____________ 。
(5) 结合表中数据、得出脱氧剂中氯化钠的作用是 _____________ (填 “ 加快 ” 或 “ 减慢 ” )铁生锈的速率。
【拓展与应用】铁生锈的原理在生活中有诸多应用
(6) 取暖用的 “ 暖宝宝 ” 主要成分与脱氧剂相同,说明铁生锈是 _____________ (填 “ 吸热 ” 或 “ 放热 ” )反应;
(7) 写出一种防止铁生锈的具体方法 _____________ 。
化学兴趣小组利用中和反应测定某 NaOH 溶液的浓度,实验过程如下:
(1) 配制稀盐酸:取 10g36.5% 的浓盐酸,加水稀释成 1000mL 的稀盐酸。所得稀盐酸中溶质的质量为 _____________g :
(2) 常温下,测定 NaOH 溶液浓度:
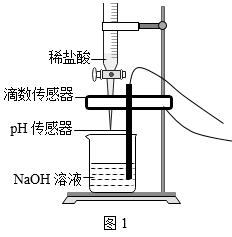
I. 取 20g 待测 NaOH 溶液于烧杯中。按图 1 所示将上述稀盐酸滴入,通过数字化传感器同时测定滴入烧杯内盐酸的体积和烧杯内溶液的 pH ,得到如图 2 所示曲线。
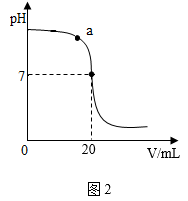
Ⅱ. 当 NaOH 溶液与稀盐酸恰好完全反应时,所得溶液的 pH 为 _____________ 。
经计算,此时已滴入烧杯内的稀盐酸中,所含溶质的质量为 0.073g 。
解:设 20 g NaOH 溶液中溶质的质量为 x 。
列出比例式 _____________ 。
求解 x=0.08g
答: 20 g NaOH 溶液中溶质的质量分数为 _____________ 。(列式并计算结果):
(3) 写出 a 点对应的溶液中大量存在的分子、离子 __________ (用化学符号表示)。