室温时某中性溶液的 pH 为
A . 1 B . 3 C . 7 D . 10
磷肥为植物生长提供的主要营养元素是
A . N B . P C . K D . Na
银元素以游离态存在的物质是
A . Ag B . AgCl C . Ag 2 O D . AgNO 3
会造成酸雨的物质是
A . SO 2 B . H 2 C . CH 4 D . N 2
下列物质的组成中含有原子团的是
A . Zn B . ZnO C . ZnCl 2 D . ZnSO 4
在水的净化过程中,可用作吸附剂的是
A .氯气 B .氯化钠 C .活性炭 D .硫酸铜
加入水中能形成溶液的是
A .氧化铜 B .铁粉 C .氢氧化铁 D .硝酸钾
互为同素异形体的一组物质是
A .氧气和臭氧 B .冰和干冰 C .生石灰和熟石灰 D .纯碱和烧碱
用盐酸除去水垢中 Mg ( OH ) 2 的化学方程式为 Mg ( OH ) 2 +2HCl = MgCl 2 +2H 2 O 。该反应属于( )
A .化合反应 B .分解反应 C .复分解反应 D .置换反应
干垃圾焚烧可用于发电,焚烧前一般需粉碎处理,粉碎的目的是
A .缓解温室效应 B .使可燃物分子变小
C .使其充分燃烧 D .减少参加反应的氧气量
关于 1mol 氨 (NH 3 ) 的说法,正确的是
A .含有 1mol 氢原子 B .质量为 17g
C .氮、氢元素质量比为 1 : 3 D .氨的摩尔质量为 17
在 CO+CuO Cu+CO 2 ,反应中, CO 表现出
A .稳定性 B .还原性 C .可燃性 D .助燃性
关于电解水实验中生成的氢气和氧气,说法正确的是
A .都是无色气体 B .体积比为 8 : 1
C .物质的量之比为 1 : 1 D .密度均大于空气
关于二氧化碳的说法,正确的是
A .二氧化碳分子由碳原子和氧分子构成 B .能使紫色石蕊试液变蓝
C .常用块状大理石和稀硫酸反应制得 D .可用于制作碳酸饮料
5% 的葡萄糖溶液可用于补充人体所需能量, “5%” 表示
A .葡萄糖的质量分数 B .每 100g 溶液中含 5g 葡萄糖
C .葡萄糖的溶解度为 5g/100g 水 D .葡萄糖与水的质量比为 5 : 100
甲烷和水蒸气制氢气的化学方程式为 CH 4 +H 2 O CO+3H 2 ,有关说法正确的是
A .反应过程中碳元素的总质量保持不变 B .参加反应的 CH 4 和 H 2 O 的质量比为 1 : 1
C .若生成 3mol H 2 则有 1molCH 4 参加反应 D .反应物的摩尔质量之和等于生成物的摩尔质量之和
下图表示甲、乙、丙三类物质的相互关系,甲包含全部乙、部分丙及其他物质。下表中符合图示关系的是
| 选项 | 甲 | 乙 | 丙 | |
| A | 含金属元素的盐 | 钠盐 | 硝酸盐 | |
| B | 纯净物 | 单质 | 化合物 | |
| C | 氧化物 | 酸性氧化物 | 碱性氧化物 | |
| D | 含氢元素的化合物 | 酸 | 盐 |
A . A B . B C . C D . D
. 硫酸盐的结晶水合物通常称为 “ 矾 ” ,我国多部古籍都有记载。
(1) 东汉《神农本草经》记载,胆矾能 “ 化铁为铜 ” 。胆矾的化学式为 CuSO 4 ·5H 2 O ,胆矾受热失去结晶水的过程属于 ( 选填 “ 物理 ” 或 “ 化学 ”) 变化;将铁片浸入硫酸铜溶液可实现 “ 化铁为铜 ” ,反应的化学方程是 ,说明铁的金属活动性比铜 ( 选填 “ 强 ” 或 “ 弱 ”) 。
(2) 唐代《千金翼方》记载,明矾可入药用。明矾的化学式为 KAl(SO 4 ) 2 ·12H 2 O ,其中含有 种金属元素; K 2 SO 4 中 K 元素的化合价是 。
(3) 明代《天工开物》记载,绿矾可用黄铁矿为原料制得。绿矾的化学式为 FeSO 4 ·7H 2 O 。 FeSO 4 ·7H 2 O 属于 ( 选填 “ 纯净物 “ 或 ” 混合物 ) ; 1mol FeSO 4 中约含有 个 S 原子。
硫酸钾是重要的化工原料,在生产过程中常混有氯化钠杂质。
(1) 用洁净的铂丝蘸取 NaCl 溶液灼烧,火焰呈 色。取少量 K 2 SO 4 溶液,滴入 BaCl 2 溶液,现象是 ,反应的化学方程式是 。
(2) 硫酸钾和氯化钠的部分溶解度数据如有下表。 100℃ 时, NaCl 的溶解度为 g/100g 水; 20℃ 时, 10g 水中最多溶解 K 2 SO 4 g 。
溶解度 (g/100g 水 )
| 温度 (℃) | 0 | 20 | 60 | 100 |
| NaCl | 35.7 | 36.0 | 37.1 | 39.2 |
| K 2 SO 4 | 7.4 | 11.1 | 18.2 | 24.1 |
(3) 某 K 2 SO 4 样品中混有 NaCl 杂质,可利用溶解度差异进行提纯。称取 27.5g 样品进行实验,过程如下:
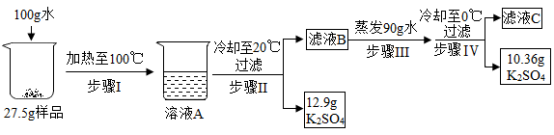
i. 溶液 B 中, K 2 SO 4 ( 选填 “ 达到 ” 或 “ 未达到 ”) 饱和状态。
ii.27.5g 样品中 NaCl 的质量是 g 。
iii. 析上述实验,说明设计步骤 II 对后续操作的作用: 。
催化剂可显著提高反应效率,二氧化锰是常见的催化剂。
(1) 实验室用 H 2 O 2 溶液制取氧气,常用 MnO 2 作催化剂反应的化学方程式是 ;用排水法收集氧气,是因为氧气 ( 选填 “ 易 ” 或 “ 不易 ”) 溶于水;将带火星的木条伸入盛有氧气的集气瓶中,现象是 。
(2)FeCl 3 对 H 2 O 2 分解也有催化作用。为比较 MnO 2 和 FeCl 3 对 H 2 O 2 分解快慢的不同影响,用下图左装置进行实验:启动传感器,注入 H 2 O 2 溶液。氧气体积分数随时间变化情况如下:
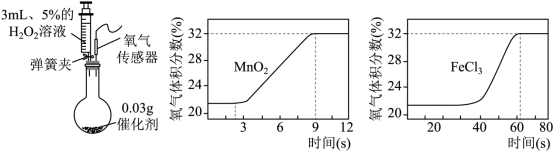
i. 初始时氧气的体积分数不为 0 ,原因是 。
ii. 写出使 H 2 O 2 分解较快的催化剂及判断依据: 。
iii. 用 5% H 2 O 2 溶液制取氧气,若采用下图所示装置进行实验,上述两种催化剂中较为合适的是 。
某种碳单质多孔材料中掺杂了氧化铁,为测定该材料中碳元素的含量,取 3.7g 样品进行实验,装置如下图所示。 ( 夹持仪器省略,空气中 CO 2 对实验的影响忽略不计 )
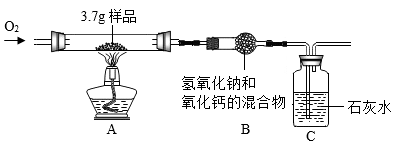
通入氧气,点燃酒精灯,使样品充分燃烧,一段时间后停止通氧气; C 中始终未出现浑浊。
(1) 氧化铁的化学式是 。
(2) 写出碳完全燃烧的化学方程式 。
(3) 将反应后装置 B 中药品放入水中搅拌,过滤。经检验,滤渣的成分是碳酸钙和氢氧化钙,其中碳酸钙的质量为 30.0g ;滤液中溶质的成分是 。
(4) 根据碳酸钙的质量能否确定样品中碳元素的含量,请分析说明 。