为了测定一瓶未密封保存的NaOH固体中NaOH![]() 的质量分数,小科采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入足量的BaCl2溶液;③待反应完全后,过滤。有关数据记录如下表:
的质量分数,小科采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入足量的BaCl2溶液;③待反应完全后,过滤。有关数据记录如下表:
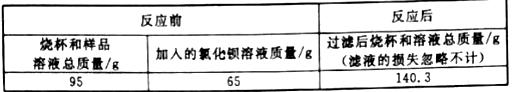
请回答下列问题:
(1)在反应前后的溶液中,下列元素质量保持不变的是 。
A.钠元素 B.碳元素 C.钡元素 D.氧元素
(2)反应共生成沉淀 克
(3)原样品中NaOH的质量分数是多少?
【答案】
(1)A (2)19.7 (3)29.3%
【解析】
(1)在反应后碳元素、氧元素生成碳酸钡沉淀,质量减少,反应前无钡元素,反应后有钡元素,钡元素质量增加,氢氧化钠中钠元素反应前后不变,碳酸钠反应后转化为氯化钠,其钠元素质量也不变,故在反应前后的溶液中,元素质量保持不变的是钠,逸因此选A;
(2)反应共生成沉淀的质量为95g+65g-140.3g=19.7g。
(3)设样品中碳酸钠的质量为x。
Na2CO3 + BaCl2== BaCO3 ↓+2NaCl
106 197
x 19.7g
![]()
x=10.6g
样品中氢氧化钠的质量=15g-10.6g=4.4g。
样品中氢氧化钠的质量分数=![]() =29.3%
=29.3%
答:原样品中NaOH的质量分数是29.3%。
本法以食盐和石灰石为原料,以氨气为媒介来生产纯碱,生产能力大,产品质量好,纯度高(纯碱即由此得名)。
侯氏制碱法:
联合制碱法是我国化学家侯德榜先生于四十年代研究成功的制碱新工艺,又称"侯氏制碱法".与氨碱法相比,联合制碱法工艺进步了很多.此法保持了氨碱法的优点,消除了它的缺点.一方面使食盐的利用率提高到96%;另一方面生产出的NH4Cl可做氮肥,是一种制碱和制氨相结合的联合生产方法.
(1)原理:NH3+H2O+CO2==NH4HCO3 ;NH4HCO3+NaCl==NH4Cl+NaHCO3↓
2NaHCO3
 Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O (2)过程:将饱和的食盐溶液在冷却时用氨饱和后在加压下通入CO2(由CaCO3分解而来),由于NaHCO3
溶解度较小而析出,将析出的NaHCO3晶体煅烧,即可制得碳酸钠。母液中的氯化铵加消石灰回收氨,以
便循环利用。制氨盐水先通入氨气,再通二氧化碳。因为氨气的溶解度大,若先通二氧化碳,则有大
部分没有溶解到海水中。
b)侯氏制碱法
第一步是:氨气与水和二氧化碳反应生成一分子的碳酸氢铵。
第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它
的溶解度较小。根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,
在278K~283K(5℃~10℃)时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥。
反应方程式:
(1)NH3+H2O+CO2==NH4HCO3
(2)NH4HCO3+NaCl==NH4Cl+NaHCO3↓
(3)2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ 即:①NaCl(饱和)+NH3+H2O+CO2==NH4Cl+NaHCO3↓
②2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ (1)原理:NH3+H2O+CO2==NH4HCO3 ;NH4HCO3+NaCl==NH4Cl+NaHCO3↓
2NaHCO3
 Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O
Na2CO3+H2O+CO2↑;然后2NH4Cl+Ca(OH)2==2NH3↑+CaCl2+H2O (2)过程:将饱和的食盐溶液在冷却时用氨饱和后在加压下通入CO2(由CaCO3分解而来),由于NaHCO3
溶解度较小而析出,将析出的NaHCO3晶体煅烧,即可制得碳酸钠。母液中的氯化铵加消石灰回收氨,以
便循环利用。制氨盐水先通入氨气,再通二氧化碳。因为氨气的溶解度大,若先通二氧化碳,则有大
部分没有溶解到海水中。
侯氏制碱法:
第一步是:氨气与水和二氧化碳反应生成一分子的碳酸氢铵。
第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它
的溶解度较小。根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,
在278K~283K(5℃~10℃)时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥。
反应方程式:
(1)NH3+H2O+CO2==NH4HCO3
(2)NH4HCO3+NaCl==NH4Cl+NaHCO3↓
(3)2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ 即:①NaCl(饱和)+NH3+H2O+CO2==NH4Cl+NaHCO3↓
②2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑