碱石灰是 CaO 与 NaOH 的固体混合物,通常用于吸收 CO 2 及干燥气体。某学校小组在实验室取了一定量的已经使用过的碱石灰样品,并对其成分进行了如下探究。
(提出猜想)该碱石灰样品中可能含有 CaO 、 ________ ( 填化学式 ) 、 CaCO 3 、 NaOH 和 Na ₂ CO 3 。
(设计方案) (1) 甲同学在烧杯中放入少量的该碱石灰样品,加入足量蒸馏水充分搅拌,静置,有白色沉淀出现,甲同学认为样品中一定含有 CaCO 3 ,你认为甲同学的结论是否严谨?
理由是: _____________
(2) 乙同学进一步设计实验并进行验证,过程如下:
| 实验操作 | 实验现象 | 实验结论 |
| ①从甲同学的烧杯中取少量上层清液于试管中,向其中滴加足量 ______ 溶液。 | 有白色沉淀生成 | 样品中一定有 Na ₂ CO 3 。 |
| ②将操作①所得到的混合物,过滤,向滤液中滴加无色酚酞试液。 | 无明显现象 | 滤液中不含有: ____ 。 |
(实验结论)你认为通过以上甲、乙两位同学的实验探究,是否可以确定该碱石灰样品的组成成分?若能,请写出其组成;若不能,请说明理由。 ______________
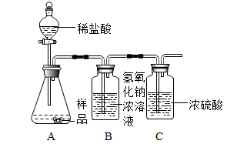
(实验反思)丙同学进一步设计了如上图所示的实验装置,通过称量 B 装置的质量变化来测定一定量样品与足量稀盐酸反应所生成的 CO 2 的质量 ( 气密性良好,每步均完全反应,操作无误 ) 。若丙同学最终测得的 CO 2 质量比实际值小,你认为可能原因是: ___________
答案
Ca(OH) 2 不严谨,可能是氢氧化钙和碳酸钠反应后新生成的碳酸钙 CaCl 2 NaOH 能, CaCO 3 和 Na 2 CO 3 锥形瓶中残留部分 CO 2 未被 NaOH 溶液吸收 ( 或锥形瓶中水吸收了部分 CO 2 )
【解析】
( 1 ) 【 提出猜想 】 通过分析可知:碱石灰是 CaO 与 NaOH 的固体混合物,通常用于吸收二氧化碳及干燥气体,氧化钙和水反应生成氢氧化钙,二氧化碳和氢氧化钙反应生成碳酸钙和水,二氧化碳与氢氧化钠反应生成碳酸钠和水;因此该碱石灰的主要成分可能含有 CaO 、 Ca ( OH ) 2 、 CaCO 3 、 NaOH 和 Na 2 CO 3 ;故答案为: Ca ( OH ) 2 ;
( 2 ) 【 设计方案 】 甲同学在烧杯中放入 2 药匙的碱石灰样品,加入 50mL 蒸馏水充分搅拌,静置有白色沉淀,甲同学认为该沉淀是 CaCO 3 ,乙同学认为他的结论不准确,理由是原样品中如果同时有氢氧化钙和碳酸钠,二者反应可以生成碳酸钙沉淀,就不能确定原来是否一定有碳酸钙沉淀;乙同学进一步设计实验并进行验证,因为氯化钙溶液和碳酸钠溶液反应生成白色沉淀碳酸钙和氯化钠,因此有白色沉淀生成;过滤,向滤液中滴加无色酚酞溶液,现象是不变红色,因此没有氢氧化钠,故答案为: ①可能是氢氧化钙和碳酸钠反应后新生成的碳酸钙② CaCl 2 ; NaOH ;
( 3 ) 【 实验结论 】 通过实验及分析,样品中只含有:碳酸钠和碳酸钙;
( 4 ) 【 实验反思 】 乙同学设计实验装置,样品中加入盐酸,通过称量 B 装置氢氧化钠溶液的质量变化来确定生成的二氧化碳的质量,从而确定样品的成分及质量,因锥形瓶中残留的 CO 2 未被吸收会导致结果偏小,而挥发出来的氯化氢及空气中二氧化碳和水蒸气被吸收则会导致结果偏大;每次实验两种因素综合作用,残留的 CO 2 质量大于挥发出来的氯化氢及空气中二氧化碳水蒸气质量导致结果偏小,反之则导致偏大