某种碳单质多孔材料中掺杂了氧化铁,为测定该材料中碳元素的含量,取 3.7g 样品进行实验,装置如下图所示。 ( 夹持仪器省略,空气中 CO 2 对实验的影响忽略不计 )
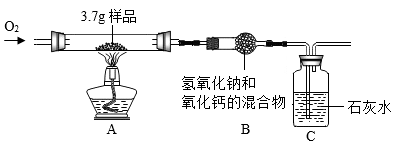
通入氧气,点燃酒精灯,使样品充分燃烧,一段时间后停止通氧气; C 中始终未出现浑浊。
(1) 氧化铁的化学式是 。
(2) 写出碳完全燃烧的化学方程式 。
(3) 将反应后装置 B 中药品放入水中搅拌,过滤。经检验,滤渣的成分是碳酸钙和氢氧化钙,其中碳酸钙的质量为 30.0g ;滤液中溶质的成分是 。
(4) 根据碳酸钙的质量能否确定样品中碳元素的含量,请分析说明 。
(1)Fe 2 O 3
(2)
(3)NaOH 、 Ca(OH) 2
(4) 能,因为 C 中未出现浑浊,说明生成的 CO 2 全部转化为碳酸钙;根据碳元素质量守恒可知碳酸钙中碳元素的质量等于样品中碳元素的质量,从而确定样品中碳元素的含量
【详解】( 1 )氧化铁即三氧化二铁,其的化学式是 Fe 2 O 3 ;
( 2 )碳完全燃烧生成二氧化碳,其化学方程式为: ;
( 3 )某种碳单质多孔材料中掺杂了氧化铁,通入氧气,点燃酒精灯,使样品充分燃烧,完全反应后会产生二氧化碳,以及氧化铁(样品中原有的), B 装置吸收二氧化碳, B 装置内发生的反应有: 2NaOH+CO 2 =Na 2 CO 3 +H 2 O ; CaO+H 2 O=Ca(OH) 2 ; Ca(OH) 2 +Na 2 CO 3 =CaCO 3 ↓+2NaOH ;根据装置内存在的反应以及反应后装置 B 中药品放入水中搅拌、过滤,滤渣的成分是碳酸钙和氢氧化钙,说明溶液中不含有碳酸钠(碳酸钠会与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠),有 NaOH 、 Ca(OH) 2 ;
( 4 )根据碳酸钙的质量能确定样品中碳元素的含量,因为 C 中始终未出现浑浊,说明生成的 CO 2 在 B 中被全部吸收,即生成的二氧化碳全部转化为碳酸钙,根据碳元素质量守恒可知碳酸钙中碳元素的质量等于样品中碳元素的质量,从而确定样品中碳元素的质量。
催化剂可显著提高反应效率,二氧化锰是常见的催化剂。
(1) 实验室用 H 2 O 2 溶液制取氧气,常用 MnO 2 作催化剂反应的化学方程式是 ;用排水法收集氧气,是因为氧气 ( 选填 “ 易 ” 或 “ 不易 ”) 溶于水;将带火星的木条伸入盛有氧气的集气瓶中,现象是 。
(2)FeCl 3 对 H 2 O 2 分解也有催化作用。为比较 MnO 2 和 FeCl 3 对 H 2 O 2 分解快慢的不同影响,用下图左装置进行实验:启动传感器,注入 H 2 O 2 溶液。氧气体积分数随时间变化情况如下:
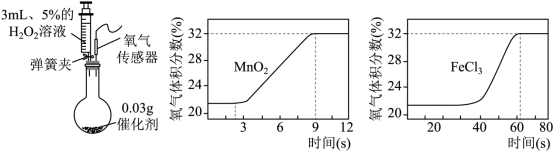
i. 初始时氧气的体积分数不为 0 ,原因是 。
ii. 写出使 H 2 O 2 分解较快的催化剂及判断依据: 。
iii. 用 5% H 2 O 2 溶液制取氧气,若采用下图所示装置进行实验,上述两种催化剂中较为合适的是 。
(1) 不易 带火星木条复燃
(2) 装置中含有空气,空气中约含 21% 体积的氧气 MnO 2 , 因为 MnO 2 作催化剂时,产生等量氧气所需的时间比 FeCl 3 短 FeCl 3
【详解】( 1 ) ① 实验室用 H 2 O 2 溶液制取氧气的原理是:过氧化氢在二氧化锰催化剂条件下分解生成水和氧气,该反应的化学方程式为: ,故填:
。
② 由于氧气不易溶于水,可用排水法收集,故填:不易。
③ 氧气具有助燃性,能使带火星木条复燃,所以将带火星的木条伸入盛有氧气的集气瓶中,观察到的现象是带火星木条复燃,故填:带火星木条复燃。
( 2 ) ① 由于装置中空气含有氧气,氧气约占空气体积的 21% ,所以初始时氧气的体积分数不为 0 ,故填:装置中含有空气,空气中约含 21% 体积的氧气。
② 比较 MnO 2 和 FeCl 3 使 H 2 O 2 分解快慢的曲线图,可知当氧气体积分数都达到 32% 时,加 MnO 2 用的时间为 9s ,加 FeCl 3 的时间大于 60s ;所以使 H 2 O 2 分解较快的催化剂是 MnO 2 ,原因是 MnO 2 作催化剂时,产生等量氧气所需的时间比 FeCl 3 短,故填: MnO 2 ,因为 MnO 2 作催化剂时,产生等量氧气所需的时间比 FeCl 3 短。
③ 选择 FeCl 3 可以使 H 2 O 2 分解反应速率适中,得到平稳的氧气流,故填: FeCl 3 。
硫酸钾是重要的化工原料,在生产过程中常混有氯化钠杂质。
(1) 用洁净的铂丝蘸取 NaCl 溶液灼烧,火焰呈 色。取少量 K 2 SO 4 溶液,滴入 BaCl 2 溶液,现象是 ,反应的化学方程式是 。
(2) 硫酸钾和氯化钠的部分溶解度数据如有下表。 100℃ 时, NaCl 的溶解度为 g/100g 水; 20℃ 时, 10g 水中最多溶解 K 2 SO 4 g 。
溶解度 (g/100g 水 )
| 温度 (℃) | 0 | 20 | 60 | 100 |
| NaCl | 35.7 | 36.0 | 37.1 | 39.2 |
| K 2 SO 4 | 7.4 | 11.1 | 18.2 | 24.1 |
(3) 某 K 2 SO 4 样品中混有 NaCl 杂质,可利用溶解度差异进行提纯。称取 27.5g 样品进行实验,过程如下:
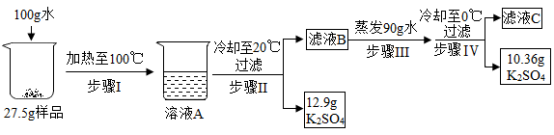
i. 溶液 B 中, K 2 SO 4 ( 选填 “ 达到 ” 或 “ 未达到 ”) 饱和状态。
ii.27.5g 样品中 NaCl 的质量是 g 。
iii. 析上述实验,说明设计步骤 II 对后续操作的作用: 。
(1) 黄 产生白色沉淀
(2) 39.2 1.11
(3) 达到 3.5 根据步骤 II 的结果,可知样品中硫酸钾和氯化钠的质量;结合溶解度数据,获得较多硫酸钾
【详解】( 1 )钠的焰色反应是黄色,所以用洁净的铂丝蘸取 NaCl 溶液灼烧,火焰呈黄色;
硫酸钾和氯化钡反应生成硫酸钡沉淀和氯化钾,则现象是产生白色沉淀,化学方程式是 。
( 2 )由表中数据可知, 100℃ 时, NaCl 的溶解度为 39.2g ;
20℃ 时, K 2 SO 4 的溶解度为 11.1g ,则该温度下 10g 水中最多溶解 K 2 SO 4 。
( 3 ) i 、析出晶体后的溶液是饱和溶液,所以滤液 B 中, K 2 SO 4 达到饱和状态;
ii 、 20°C 时,硫酸钾的溶解度是 11.1g ,而溶液 B 为硫酸钾的饱和溶液,所以 27.5g 样品中 NaCl 的质量是 27.5g -12.9g-11.1g=3.5g ;
iii 、结合前面分析和实验过程,可知根据步骤 II 的结果,可知样品中硫酸钾和氯化钠的质量,结合溶解度数据,获得较多的硫酸钾。
. 硫酸盐的结晶水合物通常称为 “ 矾 ” ,我国多部古籍都有记载。
(1) 东汉《神农本草经》记载,胆矾能 “ 化铁为铜 ” 。胆矾的化学式为 CuSO 4 ·5H 2 O ,胆矾受热失去结晶水的过程属于 ( 选填 “ 物理 ” 或 “ 化学 ”) 变化;将铁片浸入硫酸铜溶液可实现 “ 化铁为铜 ” ,反应的化学方程是 ,说明铁的金属活动性比铜 ( 选填 “ 强 ” 或 “ 弱 ”) 。
(2) 唐代《千金翼方》记载,明矾可入药用。明矾的化学式为 KAl(SO 4 ) 2 ·12H 2 O ,其中含有 种金属元素; K 2 SO 4 中 K 元素的化合价是 。
(3) 明代《天工开物》记载,绿矾可用黄铁矿为原料制得。绿矾的化学式为 FeSO 4 ·7H 2 O 。 FeSO 4 ·7H 2 O 属于 ( 选填 “ 纯净物 “ 或 ” 混合物 ) ; 1mol FeSO 4 中约含有 个 S 原子。
(1) 化学 Fe+CuSO 4 =FeSO 4 +Cu 强
(2) 两 /2 +1
(3) 纯净物 6.02×10 23
【详解】( 1 )胆矾的化学式为 CuSO 4 ·5H 2 O ,胆矾受热失去结晶水的过程中生成了新物质,属于化学变化;将铁片浸入硫酸铜溶液可实现 “ 化铁为铜 ” ,是因为铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程是 Fe+CuSO 4 =FeSO 4 +Cu ,铁置换出了铜,说明铁的金属活动性比铜强。故答案为:化学, Fe+CuSO 4 =FeSO 4 +Cu ;强。
( 2 )明矾的化学式为 KAl(SO 4 ) 2 ·12H 2 O ,其中含有两种金属元素,即钾元素和铝元素; K 2 SO 4 中 S 元素显 +6 价, O 元素显 -2 价,根据化合物中化合价的正负代数和为 0 , K 元素的化合价是 +1 。故答案为:两或 2 ; +1 。
( 3 )绿矾的化学式为 FeSO 4 ·7H 2 O ,混合物不能用化学式表示,故 FeSO 4 ·7H 2 O 属于纯净物; 1mol FeSO 4 中约含有 6.02×10 23 个 S 原子。故答案为:纯净物; 6.02×10 23 。
下图表示甲、乙、丙三类物质的相互关系,甲包含全部乙、部分丙及其他物质。下表中符合图示关系的是
| 选项 | 甲 | 乙 | 丙 | |
| A | 含金属元素的盐 | 钠盐 | 硝酸盐 | |
| B | 纯净物 | 单质 | 化合物 | |
| C | 氧化物 | 酸性氧化物 | 碱性氧化物 | |
| D | 含氢元素的化合物 | 酸 | 盐 |
A . A B . B C . C D . D
AD
【详解】 A 、钠盐属于含金属元素的盐,硝酸盐与含金属元素的盐属于交叉关系,正确;
B 、纯净物包括单质和化合物,错误;
C 、氧化物包括酸性氧化物和碱性氧化物,错误
D 、酸属于含氢的化合物,有些盐含有氢元素,正确;
故选: AD 。
甲烷和水蒸气制氢气的化学方程式为 CH 4 +H 2 O CO+3H 2 ,有关说法正确的是
A .反应过程中碳元素的总质量保持不变 B .参加反应的 CH 4 和 H 2 O 的质量比为 1 : 1
C .若生成 3mol H 2 则有 1molCH 4 参加反应 D .反应物的摩尔质量之和等于生成物的摩尔质量之和
AC
【详解】 A 、根据质量守恒定律,反应前后元素的种类和质量不变,所以反应过程中碳元素的总质量保持不变,故选项说法正确;
B 、由化学方程式可知,参加反应的 CH 4 和 H 2 O 的质量比为 (12+1×4) : (1×2+16)=8 : 9 ,故选项说法错误;
C 、由化学方程式可知,反应中 H 2 和 CH 4 的粒子个数比为 3 : 1 ,所以若生成 3mol H 2 ,则有 1molCH 4 参加反应,故选项说法正确;
D 、由质量守恒定律可知,反应物的质量总和等于生成物的质量总和,摩尔质量只是单位物质的量的物质所具有的质量,故选项说法错误。
故选 AC 。
5% 的葡萄糖溶液可用于补充人体所需能量, “5%” 表示
A .葡萄糖的质量分数 B .每 100g 溶液中含 5g 葡萄糖
C .葡萄糖的溶解度为 5g/100g 水 D .葡萄糖与水的质量比为 5 : 100
AB
【分析】 5% 的葡萄糖溶液,其含义是每 100 份质量的葡萄糖溶液中含有 5 份质量的葡萄糖,即溶液中溶质和溶液的质量之比是 5 : 100-1 : 20 ,或溶质和溶剂的质量之比为 5 : 95-1 : 19 ,或溶剂和溶液的质量之比为 95 : 100=19 : 20 。
【详解】 A 、葡萄糖的质量分数为 5% ,故说法正确,
B 、每 100g 葡萄糖溶液中含 5g 葡萄糖,故说法正确;
C 、溶解度是指在一定温度下, 100g 水中最多溶解的葡萄糖的质量, 100g 水中溶解 5g ,溶液不一定饱和,故说法错误,
D 、溶液中溶质和溶剂的质量比为 5g : 95g=1 : 19 ,故说法错误。
故选 AB 。
关于二氧化碳的说法,正确的是
A .二氧化碳分子由碳原子和氧分子构成 B .能使紫色石蕊试液变蓝
C .常用块状大理石和稀硫酸反应制得 D .可用于制作碳酸饮料
D
【详解】 A 、分子是由原子构成的,二氧化碳分子由碳原子和氧原子构成,该选项说法错误;
B 、二氧化碳不能使紫色石蕊变红,但二氧化碳与水反应生成的碳酸能使紫色石蕊试液变红,该选项说法错误;
C 、二氧化碳常用块状大理石和稀盐酸反应制得,而不是稀硫酸,该选项说法错误;
D 、二氧化碳能与水反应生成碳酸,可以用于制作碳酸饮料,该选项说法正确。
故选 D 。
关于电解水实验中生成的氢气和氧气,说法正确的是
A .都是无色气体 B .体积比为 8 : 1
C .物质的量之比为 1 : 1 D .密度均大于空气
A
【详解】 A 、氢气和氧气都是无色气体,故 A 说法正确;
B 、氢气和氧气体积比是 2 : 1 ,故 B 说法不正确;
C 、氢气和氧气物质的量之比是 2 : 1 ,故 C 说法不正确;
D 、氢气密度比空气小,氧气密度比空气大,故 D 说法不正确。
故选: A 。
在 CO+CuO Cu+CO 2 ,反应中, CO 表现出
A .稳定性 B .还原性 C .可燃性 D .助燃性
B
【详解】由化学方程式 CO+CuO Cu+CO 2 可知,在加热的条件下,一氧化碳夺取了氧化铜中的氧,是还原剂,具有还原性。故选 B 。
查看答案